
分圧 p2 の気体のそれに接した液への溶解度は比例式, Henry法則で表せる.
p2=Hx2
(H:Henry定数[単位は定義により異なる])
この法則は水についてはO2,H2,CO2,CH4などの難溶性気体,低 分圧範囲で成立する.有機蒸気(アセトン,メタノール),水中で 解離してイオンとなるもの(NH3,,SO2,Cl2)には成立しない. なお,温度が上がると溶解度は減少する.
流体の操作に関する物質収支・エネルギー収支と平衡関係に代表 される物性値がChemical Engineering の基本である。例えば化学工学の単位操作(拡散分離工学)の要点は物質収支と平衡関係を連 立させた非線形連立方程式または連立微分方程式の解法の問題である。単位操作では各種図式解法(蒸留のマッケーブーシール法,吸収塔 の図上計算,抽出の図式解法,調湿の図計算等)がおこなわれるが,これらはなんとか連立方程式を解いて装置を設計しなくてはならなかったケミカルエンジニアの先人達が工夫した, 連立方程式をグラフ上で解く巧妙な方法である。
|
【相】 |
【平衡関係】 |
【単位操作(分離操作)】 |
|
気体:液体(低濃度) |
気体の溶解度 |
吸収 |
|
気体:液体(高濃度) |
気液平衡 |
蒸留 |
|
液体:液体:液体 |
液ー液平衡 |
抽出 |
|
液体:固体 |
吸着平衡 |
(液相)吸着 |
|
気体:固体 |
吸着平衡 |
(気相)吸着 |

分圧 p2 の気体のそれに接した液への溶解度は比例式,
Henry法則で表せる.
p2=Hx2
(H:Henry定数[単位は定義により異なる])
この法則は水についてはO2,H2,CO2,CH4などの難溶性気体,低
分圧範囲で成立する.有機蒸気(アセトン,メタノール),水中で 解離してイオンとなるもの(NH3,,SO2,Cl2)には成立しない.
なお,温度が上がると溶解度は減少する.
【例題9.1】
水中にトリクロロエチレンが 1ppm 溶解している.これに平衡な 空気中の組成を求める。トリクロロエチレン蒸気-水系のヘンリー
定数は H=1.78×105kPa/モル分率。
解】 分子量を考慮して 1ppm = 1.5×10-7モル分率(= x 2).よってp2=Hx2 =2.6×10-2 kPa。 これは気相濃度にして y2 =2.6×10-4モル分率。気相中が2000倍濃縮されるので,水中の トリクロロエチレンは空気中に蒸発させることで処理される。
混合物を分ける操作で実用上最も重要なのが蒸留操作である.蒸 留酒の製法のようにもっとも伝統的分離操作と言える.蒸留は混合 液を加熱・沸騰させることで液中の蒸発しやすい成分を気相に濃縮 する方法である.これを定量的に記述するのが気液平衡である.
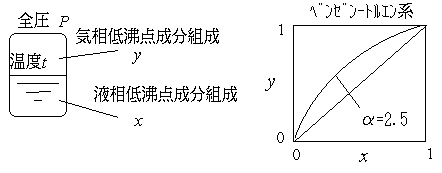
A,Bの2成分混合物について扱う.A成分が低沸点成分,B成分が高
沸点成分とする.この混合物の気相・液相が温度t, 圧力(全圧)P
で共存している平衡状態を考える.液相の低沸点成分Aのモル分率を x,(高沸点成分Bは(1-x)),気相の低沸点成
分Aのモル分率をy とする.
相律:成分数 p=2,相の数 C=2なので F=C-p+2
より自由度は2.
これは2成分系気液平衡では x,y, P
(全圧),t のうち2つ を指定すると残りは定まることを意味する.
理想溶液:熱力学では理想溶液とは次式の「ラウールの法則」が成 り立つ溶液である.

(p*は各成分の温度tでの飽和蒸気圧) なので,これを相対揮発度α:

と呼ぶと平衡関係が

で表せる.(第一成分が希薄の場合はP*2→P,
(1-x),(1-y)→1 なのでp1=P*1x1 すなわちHenry法則となる.)
非理想溶液:ベンゼン/トルエン系のような似た分子の混合物では 理想溶液として扱えるが,一般の溶液では各成分の相互作用(極性
にもとずくものなど)があり,ラウールの法則からはずれる.この ような非理想溶液では活量係数γiを導入する.

【例】メタノール(1)/水(2)系

活量係数γの相関式:活量係数は熱力学的考察にもとずいて式の形 が導かれ,混合物の組み合わせ毎に定数が実験により決められる.
①van Laar式

②Wilson式(実用上多く用いられる)

2成分溶液の気液平衡計算:(全圧およびxを与えて t,yを求め
る)は次式のようなp=f(t) の形式の非線形方程式(1変数)
を解く問題となる
![]()
すなわち


【吸着剤】 【応用】
活性炭,ゼオライト(疎水性) 空気分離,脱臭,水処理
シリカゲル,アルミナ(親水性) 気体の乾燥
吸着平衡関係は気体吸着量とq [kg-吸着気体/kg-吸着剤]と気
体分圧p [kPa]の関係で表わされる.吸着関係は温度依存性が大き
いので温度一定の条件で表示される.よって「吸着等温線」とよぶ.

ラングミュアの吸着等温式:

気体の分圧をpA,吸着剤粒子表面の 吸着分子による被覆率をθ,とすると気体の吸着速度va
は(1)式で 表わせる.脱離の速度vdは被覆率に比例するので(2)式となる.
よって平衡状態では被覆率すなわち粒子表面の気体吸着量が, (3)の形式となる.これがラングニュアの吸着式で一般的には,
(4)の形式である.

K:吸着平衡定数,
q∞:表面が単分子で覆われたときの吸着量.
ラングミュア式は触媒反応の基礎式,酵素反応の基礎式(ミカエレ スメンテン式)にも応用される.
【演習レポート⑨】 2成分系気液平衡
(問題)与えられた系について大気圧(P= 101.3kPa)での気液平 衡を4点以上計算して x-y図及び x,y -T図上に描け。提出は A4方眼紙で下の様式にて。
系0:アセトン / メタノール系 (共沸系),系5:メタノール / ベンゼン系(共沸系)
系1:アセトン / エタノール系 , 系6:メタノール / ミズ 系
系2:アセトン / ベンゼン系, 系7:ヘキサン / ベンゼン系
系3:アセトン / ミズ 系, 系8:エタノール / ベンゼン系(共沸系)
系4:メタノール / エタノール系, 系9:エタノール / ミズ系
(与えたプログラムで使用する成分,系の行頭「’」を削除する。)
注意:BASICにおける注釈行印「’」 は[U]のところにある。「,」 と間違えないように。