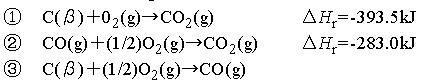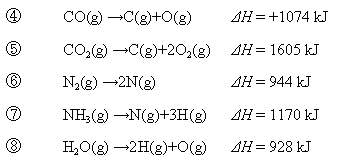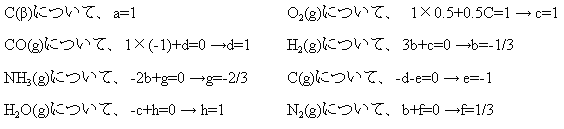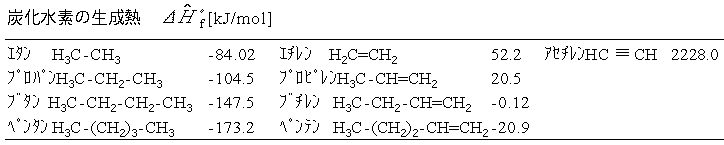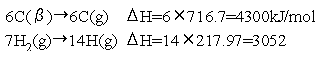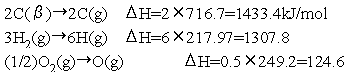!祝! 熱化学方程式の廃止
(2019/9/6)
遂に高校化学から「熱化学方程式」が廃止となり,化学反応のエネルギーが「エンタルピー変化」で教科書に書かれ,教えられることになります。エントロピーも登場します。2022年から新しい教科書による授業が始まります。当方もこのページ(下のほう)で20年以前からアピールし,高校化学の先生に
は機会ある毎に話題にしていたことが実現しました。「日本(高校化学)の常識は世界の非常識」がやっとひとつ改められました。日本にも自ら改革する力はある?(
先生方や受験産業は対応がたいへんでしょうが・・)(なお,公的試験類(技術士,薬剤師,ガス主任,危険物等)
は最近まで熱化学方程式が残っていたものもありますが,おおかたは既になんとなくエンタルピー方式に移行しているようです。)
詳しくは
化学と教育 2018年 9号 p. 454 後飯塚由香里:(論壇) 熱化学方程式は必要か
を参照ください。以下に改定された高等学校学習指導要領解説の該当部分を新旧比較して示します。
|
(新) 高等学校学習指導要領解説
理科編 理数編 平成30年7月(pdf) |
(旧) 高等学校学習指導要領解説 理科編 平成21年7月 |
| (p. 115) 「化学」の内容とその範囲,程度/(2)物質の変化と平衡/(ア) 化学反応と熱・光について |
(p. 65) 「化学」の内容とその範囲,程度/(2)物質の変化と平衡/(ア) 化学反応と熱・光について |
|
中学校では,第1分野「(4)ア(イ)(ウ)の化学変化と熱」で,化学変化には熱の出入りが伴うことについて学習している。
ここでは,化学反応と熱や光に関する実験などを行い,化学反応の前後における物質のもつ化学エネルギーの差が熱,光の発生や吸収となって現れることや,化学エネルギーの差を定量的に扱えることを理解させることがねらいである。
熱の発生や吸収については,反応熱が生成物と反応物のもつそれぞれの化学エネルギーの総和の差で表せることやヘスの法則を扱う。化学エネルギーの差については,エンタルピー変化で表す。また,反応熱と結合エネルギーとの関係にも触れる。吸熱反応が自発的に進む要因に定性的に触れる際には,エントロピーが増大する方向に反応が進行することに触れることが考えられる。
|
中学校では,第1分野「(4)イ(ウ)化学変化と熱」で,化学変化には熱の出入りが伴うことについて学習している。
ここでは,化学反応の前後における物質のもつ化学エネルギーの差が熱,光の発生や吸収となって現れることや,これらのエネルギーの出入りが熱化学方程式で表せることを理解させることがね
らいである。
熱の発生や吸収については,反応熱が生成物と反応物のもつそれぞれの化学エネルギーの総和の差で表せることやヘスの法則を扱う。その際,反応熱と結合エネルギーとの関係にも触れる。
|
>河合塾:高等学校学習指導要領分析 化学基礎・化学(2018.10)
2022年3月現在,書店にある本では以下がエンタルピー方式の高校熱化学を解説しています。
後藤ら:「資質・能力」を育む高校化学」,化学同人(2019)
化学図録 新課程版,数研出版 (2022)
2022年5月 教科書の資料が公開されはじめました:
第一学習社 令和5年度用教科書のご案内>高等学校 化学>化学基礎+化学教科書ダイジェスト版(pdf)のpp.
56-76
11.0 反応の推進力
11.1 熱化学計算
反応熱:反応熱には各種あって,燃焼にともなう発熱を燃焼熱,中和反応に伴う発熱を中和熱,溶解に伴う吸・発熱を溶解熱と呼ぶ
。しかし、このような区別はあまり意味はなく、以下のように実際は全て同じもの(エンタルピー変化)である。)
熱化学計算の約束:
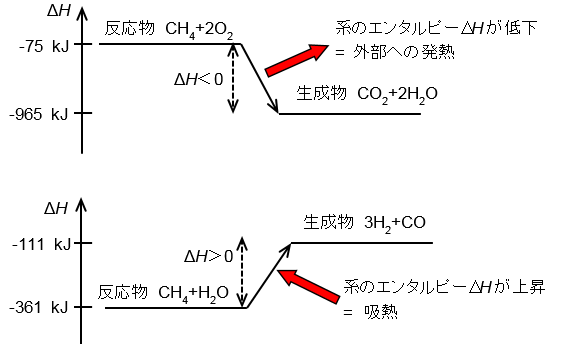
例えばメタンの燃焼反応を高等学校の化学で学習した熱化学方程式で書くと,
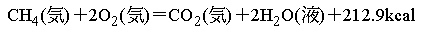
であり,末尾の数値が反応熱であった.(新課程では熱量の単位がkJとなっている。)
この熱化学方程式における反応熱は、発熱反応では+,吸熱反応ではーの記号で示され,直感的に解りやすい。この式は「方程式」なので、式中の化学式はその物質の持つ”エネルギー”をあらわす代数記号である。"="により式の左右は等しい、すなわち左右のエネルギーは等しいことを意味している。この場合、生成物CO2+2H2O(3
mol) は反応物 CH4+2O2(3 mol) より212.9 kcalエネルギーが 低い ことを意味する。
しかし前章で熱力学の基礎から、正式な熱力学的物理量(系の状態量)であるエンタルピ ーH
を導入したので,以後は各種の熱はエンタルピーにより測ることとする。そして,反応前後のエンタルピー変化ΔH
を
(エンタルピー変化ΔH
)=(生成物質の持つエンタルピー)−(反応物質の持つエンタルピー)
で定義する.
すると,熱化学における反応式・反応熱の記述はこのようになる。

ここで,高校における「反応熱」と「エンタルピー変化」では符号が逆になっていることに注意する.反応の結果,ある系のエンタル
ピーが低下したことは,外部への熱の放出または仕事に等しい.また,反応式と反応熱は独立して書くことに注意.
高校の方法と違って、両者を独立に書くことで、熱化学計算での化学式と数値で ある熱量との取り扱いが明確となる。(注参照)
エンタルピーを使うことの意味は、圧力一定の変化の前後で体積仕事 を同時に考慮することにある.たとえばアンモニアの生成反応:
(1/2)N2(g)+(3/2)H2(g)→NH3(g)
の標準反応熱はΔH゚r= -46.1 kJ が観測される.この反応では系 の体積が 2 molから 1
mol減少しているので系の占める体積による内部 エネルギーも減少する.(温度一定で体積を減少するにはエネルギ
ーを放出する必要がある.)よって実際の系の内部エネルギー変化 すなわち定容下での反応熱は以下のようである。
ΔU゚r=ΔH゚r−ΔnRT
= -46.1 kJ-(-1)(8.31 J/(k・mol))(298) = -43.6 kJ
熱化学計算におけるHessの法則(総熱量保存の法則):熱力学第一法
則の結論より,化学反応に伴い生成または吸収する熱すなわち反応熱は反応のはじめと終りの状態のみで決まり,途中の経路には関係
しない.この関係は1840年に多くの反応熱の測定によりHessがみい
だした.このHessの法則を利用すると,既知の反応とその反応熱の組み合わせにより、未知の反応の反応熱が求められる.
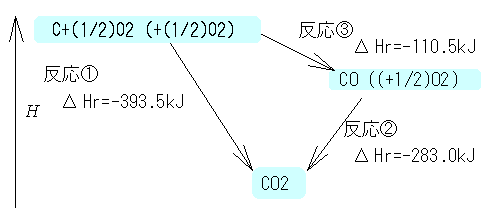
【例題11.1】 CO2を生成するふたつの反応①②から,
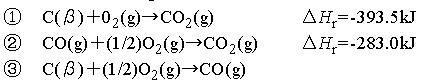
③の反応熱を求める.(ただしC(β)は黒鉛炭素を表す)
【例題11.1解】
①−②が③となるので,求める反応熱は,
ΔHr =(-395.51)-(-283.0)=-110.5 kJ
【例題11.2】
分子を個々の原子に分解するために要するエネルギーはCO: 1074 kJ/mol, CO2:
1605 kJ/mol, N2: 944 kJ/mol, NH3:
1170 kJ/mol, H2O: 928 kJ/mol
である。これと下記のエンタルピー変化を用いて、黒鉛(C(β))10 gを完全燃焼させたときに生じる発熱量をもとめよ。
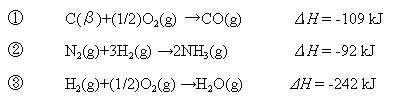
(大学入試より。(89東大) だだし原文は当然「熱化学方程式」で記述されている。)
【解】各分子の分解エネルギーより、
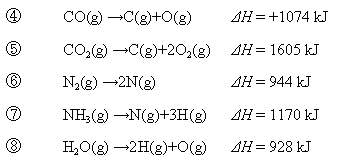
これらの式を適当な係数を乗じて加えあわせて
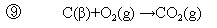
とする。例えば①:C(β)+(1/2)O2(g) -CO(g)
のように生成物を移項して扱う。
①×a+②×b+③×c+④×d+⑤×e+⑥×f+⑦×g+⑧×h = ⑨
として、左右の化学種の係数を比較する。
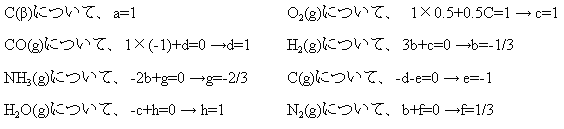
よって、①-②×(1/3)+③+④-⑤+⑥×(1/3) -⑦×(2/3)+⑧ = ⑨ である。
これをΔH について 計算することで、⑨のΔH
= -339 kJ となる。よって求める発熱量は 339×(10/12)=283 kJ。
燃焼のように反応は発熱を伴う場合が多く、反応は系のエンタルピーΔH
が減少する方向に進行する(発熱反応)場合が多い。しかしそうで無い場合,吸熱反応が自発的に進む場合もある。熱力学的に正しくは
「反応はギブスエネルギー ΔG
= ΔH
-(T・ΔS
)が減少する方向に進む」 である。(T :温度、S :エントロピー)すなわち反応はΔH
が減少(内部エネルギーの減少)とエントロピー(T・ΔS
)の増加のかねあいで進行方向が決まる。エントロピーS
とは「分子の乱雑さ」である。(固体より液体のほうが乱雑さが大きい。)室温付近ではエントロピー変化ΔSはエンタルピー変化ΔHに比べて小さいので、
ギブスエネルギー変化ΔG
はエンタルピー変化に支配される。すなわち発熱反応が起きやすい。一方、高温ではエントロピーの寄与が大きくなる。一般に分子が高温で分解しやすいのはエントロピー効果である。水素を製造する改質反応もこの例であり,工業的には生成物のエンタルピーが高くなる
ような吸熱反応の方が有用である。
【例】
吸熱反応の例示で有名な水酸化バリウムとチオシアン酸アンモニウムの反応:
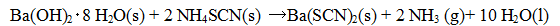
は反応熱(吸熱で102.2 kJ)より,分子数の増加(3 molから13 mol)によるエントロピーの増加(495
J/mol-K)が上回るため,吸熱反応ではあるが室温でも反応が自発的に進む。
11.2 標準生成熱 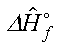
標準状態:熱化学における標準状態は圧力が1
bar(100 kPa)とする。温度は約束温度 25℃ (298.15K)で表示される。
標準生成熱:標準生成熱( standard heats of formation) 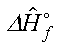 は
標準状態における化合物のエンタルピーとそれ を構成する元素の全エンタルピーの差で定義される. この添え字記号で o は標準状態(1 bar), f は生
成(Formation), ^ は1mol当たりを表す。
は
標準状態における化合物のエンタルピーとそれ を構成する元素の全エンタルピーの差で定義される. この添え字記号で o は標準状態(1 bar), f は生
成(Formation), ^ は1mol当たりを表す。
分子中の結合エネルギー:生成熱,反応熱は目に見えない分子の結合の組み替えが我々の測定できる熱として外部に表れたものである。
逆に言えば生成熱により分子中の原子同士の結合エネルギーがわか る。
【例題11.2】
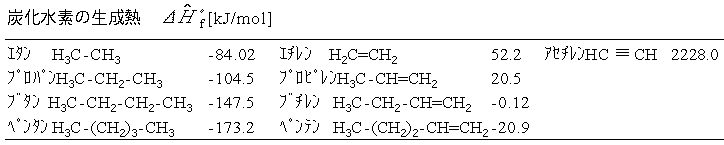
この表を横にみると2重結合は単結合より1 mol当り約125 kJエネルギーが高い。これが不飽和炭化水素の反応性が高いことの現れである。 実際に脱水素反応:
H3C-CH3 (高温・白金触媒)→ H2C= CH2 +H2
ΔH ゚r=136 kJ
は吸熱反応である。また,表を縦にみると1重結合は約21 kJ/molのエネルギーであるとわかる.
生成熱に関する知見や量子力学による理論計算(例:(1/2)H2(g)
→H(g))分光学的測定などの種々の方法により,分子内の結合のエンタルピー(結合の解離反応のエンタルピー変化)が決定されている.

黒鉛C(β)がC(g)となる炭素の原子化(気体化)については特に測 定が困難であったが,次が現在採用されている.
C(β)→C(g) ΔH ^=718 kJ/mol
結合エンタルピーにより化合物の生成熱を大まかに見積もることができる.
【例題11.3】
nーヘキサンC6H14(g)の生成熱を結合エネルギーから推算せよ.
【例題11.3解】
ヘキサン分子中には14個のC-H結合,5個のC-C結合がある.また C原子が6個,H原子が14個ある.各化学結合について表の値を用いると,
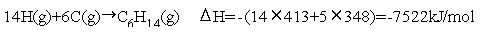
C,Hについて,標準状態で安定した元素を気体原子にするための原子 化エンタルピー変化
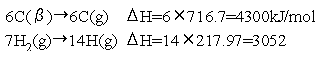
を加えて,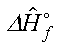 =−170 kJ/mol となり文献値:
=−170 kJ/mol となり文献値: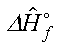 =-167 kJ/molとほぼ一致する.
=-167 kJ/molとほぼ一致する.
【例題11.4】
エタノールC2H5OH(g)の生成熱を結合エネルギーから 推算する.文献値は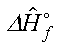 =-235.3kJ/mol
=-235.3kJ/mol
【例題11.4解】
エタノール分子中の各化学結合について表の値を用いると,
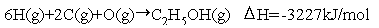
これと次のCについては黒鉛,H,Oについては標準状態で安定した分子を気体原子にするための原子化エンタルピー変化
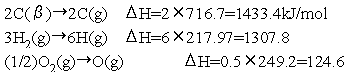
を加え合わせて,エタノールの生成熱が次のように推算される.この場合はあまり合わない.
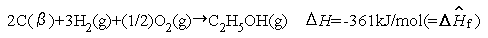
【演習レポート⑪】 Hessの法則による反応熱の推算
以下の各種の燃焼反応の反応熱が与えられている.H2Oの (g),(l )に注意.H2O以外は全て(g).
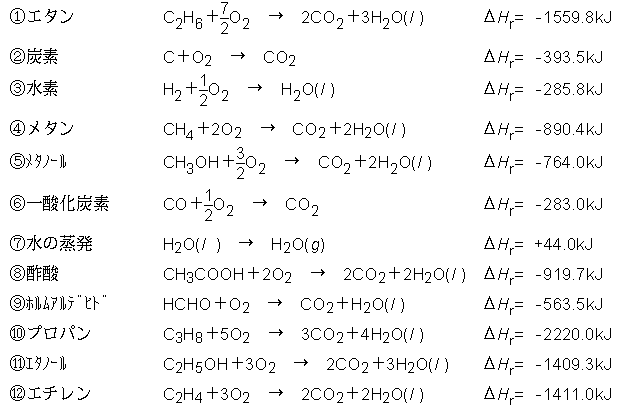
これらとHessの法則を用いて以下の各反応のうち2つの反応の反応 熱ΔHrを推算せよ.

注)
私の手元にある欧米の物理化学、化学工学基礎の教科書(原書)および日本の大学の関係教科書にはひとつも高校の方式の「熱化学方程式」はない。
以前はあったようであるが、現在は日本の高校だけの特殊な教え方のようである。
日本の高校化学 :林正幸氏の教科書|理論化学
熱化学方程式
FNの高校物理/反応熱と熱化学方程式(このページは熱化学方程式とエンタルピー方式を混在させて説明しており
ユニークである。高校化学と大学の物理化学を接続するべく,たいへんな努力をされている。)
外国:Hess's
law - Wikipedia, the free encyclopedia|YouTube
"Thermochemical equation"|韓国の高校化学| YouTube
ヘスの法則
1 化学式(”代数記号”とのことである)と数値を=で結び、「方程式」と呼ぶのは先ず感覚的にヘンである。
2 「熱化学方程式」を使うがために,燃焼熱,生成熱は正の値としなくてはならない。 例えばメタンの燃焼の熱化学方程式は,
CH4(気) + 2 O2(気) = CO2(気) + 2 H2O(液)
+ 890.3 kJ
であり,+ 890.3 kJがメタンの燃焼熱となる。すると便覧類に記載の値とは符号が逆になる。(「化学便覧」では「燃焼エンタルピー」としている。)
3 熱化学方程式中の化学式は「その物質の持つ化学エネルギー」または「保有エネルギー」
の数値をあらわすとのことであるが,これは上の定義の生成熱とも燃焼熱とも違う第3の量である。 例えば熱化学方程式:
CH4(気) + 2 O2(気) = CO2(気) + 2 H2O(液)
+ 890.3 kJ
は数値としては: (-74.8) + 2×( 0 ) = (-393.5) + 2×(-285.8) + 890.3
でなくてはならないが,この:CH4(気) = -74.8 kJ
を説明するのに「保有エネルギー」を持ち出す。「保有エネルギー」とは ,
(熱化学方程式での化学式=物質の保有エネルギー)=−(高校での生成熱)=(一般に言う生成エンタルピー)
となっている。熱化学方程式を理解させるために「保有エネルギー」という別のものを持ち込むことで,かえって学習者を混乱させる結果になってはいないか?
いっそ物質の「保有エネルギー」すなわち「生成熱」と言ってしまえばスッキリするのに・・・(最近は「保有エネルギー」は使わずあいまいにしているようである。)
4 最近の高校教科書には 「エネルギー図」と称する図式がたくさん登場しており,エネルギー図による熱化学
の教え方が主流である。しかし,「燃焼熱はプラスの値(増加)なのに「
エネルギー」の位置はなぜ低下するのか?」,「その縦軸「エネルギー」の具体的な値はなにか?」など,生徒はかえって混乱するのではないか。
5 以上のような熱化学方程式のわかりにくさに起因して,物理化学の理解と関係ない妙な「受験テクニック」が発展している。(例えば,エネルギー図の書き方の指導や「燃焼熱は(反応物−生成物)」
,「熱代入法」。)
熱化学の計算は,各物質の標準生成エンタルピー
の値を最初に示し,標準反応熱は(生成物(現在)のエンタルピー)マイナス(反応物(過去)のエンタルピー)とするだけで全て解決である。エネルギー図も不要である。
私はいつも大学化学は高校でならったことの延長であり,受験勉強は役に立つと講義室で言っているのであるが,「熱化学方程式」だけは高校教育を否定しなくてはならない。「熱化学方程式」から「エンタルピー方式」への切り替えは日本の全大学
の講義室で毎年おこなわれることであり,膨大なムダを生じている。
下にこの件に関する参考文献:
玉虫伶太, "高校の化学教科書への意見 Ⅱ −熱化学方程式は必要か−": 化学と教育, 38巻, p. 464 (1990)
を抜粋する。(このような高名の学者が以前から主張しておられるのに、いっこうに改まらないのは不思議なことである。)
|
「熱化学方程式とは何か?理化学辞典1)によると、”化学反応にともなって出入りする熱量すなわち反応熱*(注)を明示した化学方程式。・・・+が発熱、ーが吸熱を示す・・”となっている。・・
(私の注)実は理化学辞典も「反応熱」の項には「反応熱は発熱反応で負、吸熱反応で正になる」と記されており、混乱している。
熱化学方程式は、化学変化に伴う熱の出入を直感的に表すのに都合のよい方法として、かつては広く用いられていた2)。しかし、この方法は、決して厳密なものではなく3)、また必ずしも論理的な表現とはいえない。・・・
科学の学習の初歩においては、厳密さや論理性を多少犠牲にしてもわかりやすさに重点をおく必要があるわけで、それには、新しい論理的な解説よりもむしろ歴史的な表現を用いる方が有効なことも多い。しかしながら、反応に伴う熱の出入という特定の課題についていえば、前述のような問題点をはらんでいる古典的な熱化学方程式をつかわなければならない必然性はみあたらない。高校の段階では、内部エネルギーやエンタルピーの概念を導入することは不可能であろうし、また定圧反応熱と定容(定積)反応熱とを区別する必要もない。そこで、高校の教科書では、反応熱を
(反応熱)=(生成系のエネルギー)−(原系のエネルギー) (6)
のように定義して、熱化学的な現象を、例えば
C(固)+O2(気)=CO2(気) : 反応熱= -94.1 kcal (7)
のように表現するのがよいであろう。・・・高校の教科書の中には熱化学方程式と並べて、事実上(6)と同等の説明を付け加えているものもあることを考えると、(2)の形の古典的な熱化学方程式を高校の教科書から全面的に削除することに特別な困難はないと思われる。・・・」 |
(追記2008.3.27)
渡辺 正・北条博彦:高校で教わりたかった化学,日本評論社
(2008.2) の「終章 教科書の記述は正しい・・のか?」で熱化学方程式が不要なものとして挙げられたている。
(追記2013.7.27) ついに黒船出現か?:化学会が熱心におこなっている化学オリンピック,高校化学グランプリでは
当然世界標準のエンタルピー方式である。この関係の先生方は
指導に苦労していると推察される。この方面をきっかけにしてこの「日本の常識は世界の非常識」の典型例がいよいよ「開国」(熱化学方程式廃止
)を余儀なくされるのではないかと期待する。(あと10年と予想してみる。)
(追記2015.7.29) 日本化学会が中学・高校教科書に対する「化学用語に関する提言」をおこなっている。その第2回(2015年6月)で
はじめて「熱化学方程式」の見直しを提案している。(下記)現在意見募集であるがいずれ正式な提言となる。ようやく高校教科書から熱化学方程式の廃止が実現しそうである。これには化学用語検討小委員会の委員長が渡辺 正先生になったことではじめて実現できたことと推察される。渡辺 正先生のご尽力に感謝したい。
化学用語に関する提言(案) (第2回)(2015.6)
(C)見直すぺき表現法(1件)
10.反応熱などの符号
【現状】日本の高校では, N2(g)+3 H2(g) = 2 NH3(g) + 92
kJ のような表記を「熱化学方程式」と呼び,発熱を正値,吸熱を負値で表す。
【案】(中長期的な視点に立てば)化学反応で出入りする熱は,エンタルピー変化 ΔH で表すのが望ましい。
【理由・背景】大学の化学熱力学では ΔH
を使うため,発熱・吸熱の符号が逆転する。 日本の「熱化学方程式」は,古いPauling
『一般化学』などの表記を引き継いだものだろうが,いま欧米では高校でも ΔH
を使い,日本と同じ表記法の教科書は見当たらない[反応式(N2(g) + 3 H2(g)→2 NH3(g))とエンタルピー変化( ΔH
= -92 kJ)のセットを“theimochemical equation”
と呼ぶ]。エンタルピーを教える手間は増すものの,本件では大学への接続を主眼とするのが望ましい。
(参考)化学と教育 2019年 1号 p. 38 日本化学会化学用語検討小委員会:高等学校化学で用いる用語に関する提案(2)への反応
(ここでは「熱化学方程式の廃止」に否定的(時期尚早)な意見ばかりであったという。)
(最近の情勢2019.9.6
(そしてとうとう終結。次のターゲットは「平衡定数」か?(高校化学 世界標準
FENの高校物理:平衡状態の熱力学)))
渡辺正:大学と切れた高校化学−病状・原因・治療法−,高分子,
57巻, 4号, p. 224 (2008)
化学と教育 2012年 3号
p. 92 渡辺 正: (ヘッドライン)
望ましい高校化学
化学と教育 2017年 9号
p. 428 今井 泉:中等教育化学における「化学反応とエネルギー」の現状と課題
化学と教育 2018年 9号
p. 454 後飯塚由香里:(論壇) 熱化学方程式は必要か
化学と教育 2020年 12号
p. 501 後藤顕一 変わる!高等学校での「熱化学」