最もなじみ深い有機物であるエタノールは生産量も多い。工業的生産だけでも合成法で17万 kL/年、発酵法で27万kL/年生産される。
エタノールの合成は1919年硫酸吸収法による工業化がなされ、1948年直接水和法が開発された。
(触媒:珪藻土にリン酸を含浸させたもの、反応条件:300℃ 70 atm、エチレンの単通収率4%、反応器出口でのアルコール濃度 6.5mol%)
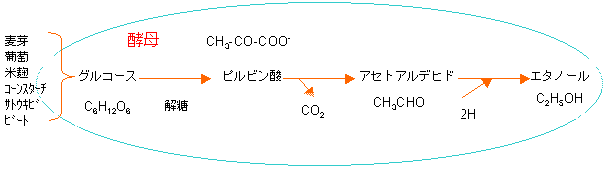
一方発酵法は糖からエタノールまでの多くの反応段階を酵母が全ておこなう。

エタノールは石油がなくなっても生物で生産可能なエネルギー源である。しかし水溶液から純粋のエタノールを分離することは「共沸点」の存在により簡単なことでない。現状では分離のコストがアルコールの原料(糖)と同程度も占めている。画期的な分離技術の開発によりエタノールを安価に製造できればエネルギー問題に寄与できる。
エタノールと水を分離するために利用できる性質の第一は「揮発性」である。水よりエタノールのほうが揮発性が大きい=蒸気圧が大きい(=沸点が低い)。
混合物中の各成分の揮発性をあらわす方法が気液平衡である。混合液中の濃度とそれに平衡にある蒸気の濃度を図にすることで、蒸留における分離の程度を定量的にあらわすことができる。



成分の揮発度の差を利用する分離プロセスが蒸留であり、古くから蒸留酒の製法に用いられてきた。
 |
らんびき (蘭引)
3段重ねの陶器でできている。下部の瓶に酒を入れ、沸かす。上部に冷却水を入れることで、その底で蒸気が凝縮し、中段の出口から蒸留酒が得られる。 「らんびき」の名称はポルトガル語の Alambique からきたもの。16世紀後半、南蛮文化とともにもたらされた。南蛮外科で傷口を洗う蒸留酒や薬用油水(植物精油)、化粧用香油水を造るのに用いられた。 (内藤記念くすり博物館で購入できる) |
 |
香水製造用蒸留器 |
| ブランデー製造用ポットスチル |  |
蒸留塔は気液平衡関係を何段階も利用できるよう、多段の塔であり、さらに還流という操作をおこなって分離効果を高めている。






単なる蒸留では共沸点までしか濃縮できないので、純エタノールを得るには共沸蒸留という特別な蒸留法が用いられている。エタノール水溶液にベンゼンを混ぜることで、非極性のベンゼンが水をより揮発性にし、一方エタノールにも同様のはたらきをするが、それほど大きくないことを利用する。(ベンゼン沸点80℃、水ベンゼン混合液沸点69℃、エタノール沸点78℃)
